Псевдомембранозный энтероколит: что такое, причины и лечение
Псевдомембранозный энтероколит – патологическое состояние инфекционно-воспалительного характера, которое прогрессирует вследствие длительной антибиотикотерапии. Характеризуется формированием на слизистой кишечника специфических фибринозных бляшек. Данный недуг не имеет ограничений касательно половой принадлежности или возрастной категории. Протекает болезнь очень тяжело и часто даёт осложнения – наиболее распространённое из них это прободение кишечной стенки и прогрессирование перитонита.
Псевдомембранозный энтероколит развивается вследствие патогенной активности специфического микроорганизма — Clostridium difficile. В нормальном состоянии данный бактериальный агент входит в состав микрофлоры кишечника человека, но под воздействием различных неблагоприятных факторов он активизируется и начинает стремительно размножаться. Увеличение численности микроорганизмов и приводит к прогрессированию патологии.
Подробнее о патологии
Болезнь толстого кишечника, при котором происходят острые воспалительные процессы слизистой оболочки клостридиального генеза. Второе название – мембранозный колит. Он возникает вследствие инфицирования патогенной микрофлорой – Clostridium difficile. В отделах кишечника живут 50 триллионов полезных лакто – и бифидо-бактерий у взрослых, которые поддерживают процессы пищеварения, участвуют в синтезе витаминов и иммунной защите.
При заболевании органа происходят патологические изменения в структуре кишки, нарушаются физиологические функции, микрофлора погибает. Вместо полезных лакто – и бифидо-бактерий в кишечнике начинается активный рост и развитие патогенной микрофлоры – клостридии, стафилококки, стрептококки.
Воспалительные, острые поражения кишечника происходят после антибиотиков и других лекарственных средств (меларсопрол, пентамидин или сурамин). Полезная микрофлора погибает, а условно – патогенная (клостридии, энтерококки, стрептококки и другие) начинает активно расти и размножаться. Клостридии выделяют в процессе жизнедеятельности самые опасные яды, которые воздействуют не только на ЖКТ, но и на ЦНС человека.

Воспаление тканей толстого кишечника приводит к тяжелым нарушениям в работе органа. Псевдомембранозный колит относят к ВБИ (внутри больничным инфекциям), так как 65% заболевших проходили лечение других болезней в стационаре (после операций, тяжелых инфекций). Предрасполагающими факторами, повышающими риск инфицирования клостридиями (патогенный микроорганизм), являются: возраст – после 60 лет и до 14 лет (особенно дошкольного возраста); наличие тяжелых заболеваний или операций в анамнезе (онкология, резекция кишечника или желудка, отсутствие желчного пузыря и другие). Этот недуг поражает взрослых здоровых людей после приёма антибиотиков лишь в 5% случаев.
Клиническая картина заболевания
Клиническая картина заболевания зависит от длительности протекания клостридиальной инфекции в организме и от степени. Характерный симптом болезни – постоянная, изнуряющая диарея. Причина ее в токсических отходах процессов жизнедеятельности клостридий.
На начальной стадии развития болезни у пациента появляется диарея. Характер болевых ощущений в области живота – схваткообразный, иридирующий в поясницу. У больного возникают постоянные тенезмы, диарея: обильная, водянистая, с фрагментами слизи и краплений. Нарастают общие признаки интоксикации при заболевании, основными признаками которой являются: температура повышена до 38 – 40, усталость, тошнота, головная боль, приступы резкой тошноты и рвоты.
Аллергические реакции на токсины бактерий могут проявляться на коже в виде сыпи и покраснения кожных покровов. На тяжелой и терминальной стадии кишка гиперемирована, её ткани атрофируются и некротизируются. Она не способна выполнять все физиологические функции, из-за этого нарушаются процессы пищеварения, свертываемости крови, уменьшаются защитные силы иммунитета.
Пациенты жалуются на постоянные тенезмы и изнуряющие приступы диареи. Стул становится желтовато – бурого или зеленоватого оттенка. В нем преобладают слизь, кровь. Появляются признаки обезвоживания, дегидратации и патологического изменения водного электролитного обмена. На этой стадии у пациента диагностируются нарушения белкового метаболизма. Формируется токсический мегаколон.
Наступает тяжелая патология стенок кишечника – их прободения с забросом его содержимого в брюшную полость – перитонит. Основной его признак – «твердый» живот. Смерть наступает при мембранозном колите вследствие заражения брюшной полости патогенными бактериями, содержащимися в органе; вследствие обезвоживания и патологических расстройств водного электролитного и белкового обмена.
Возможны тремор, судороги. У пациента начинается дизурия. Кожные покровы становятся сухими, белого цвета. Из-за расстройств пищеварения может начаться анорексия у больных. В воспалительный процесс вовлекается тонкий кишечник – энтероколит. Это типичное осложнение псевдомембранозного колита у взрослых.
Причины
Наиболее часто псевдомембранозный колит возникает при использовании таких антибиотиков, как Линкомицин и Клиндамицин. Реже встречаются случаи заболевания после приема Ампициллина, Пенициллина, Тетрациклина, Эритромицина, Левомицетина, Цефалоспоринов. По некоторым данным псевдомембранозный колит могут вызывать практически все антибиотики, а также некоторые цитостатики и слабительные средства.

Непосредственной причиной заболевания становится специфический дисбактериоз с преобладанием одного микроорганизма – Clostridium difficile. Это условно-патогенная бактерия, которая обнаруживается у 0-3% здорового населения разных возрастных групп, особенно часто у детей и новорожденных (до 50% инфицированности — в самых младших возрастных группах). Кроме того, Clostridium difficile широко распространена в природе: обнаруживается в почве, и обитает в кишечниках многих животных – как диких, так и домашних.
Как правило, специфический клостридиальный дисбактериоз развивается при длительном употреблении антибиотиков внутрь, однако описаны случаи возникновения псевдомембранозного колита после инъекционного использования антибиотиков. Clostridium difficile выделяет токсины, пагубно влияющие на эпителий кишечной стенки. Такие антибиотики как Линкомицин, Клиндамицин и, в меньшей мере, Пенициллины — способны усиливать действие токсинов бактерий в десятки, и даже сотни раз.
Предрасполагающими факторами к развитию псевдомембранозного колита являются: 1. Возраст старше 65 лет. 2. Наличие таких тяжелых сопутствующих патологий, как онкологические заболевания и почечная недостаточность, госпитализация в отделение интенсивной терапии, обширные хирургические вмешательства.
Практически у 4 процентов населения абсолютно разных поколений выявляется эта условно-болезнетворная бактерия, которая при здоровой кишечной микрофлоре является абсолютно безопасной. Обычно специфический клостридиальный дисбиоз формируется из-за длительного приема антибиотиков перорально. Поскольку именно в этом случае наблюдается особенно негативное влияние на кишечную микрофлору. При инъекционном введении препарат всасывается, минуя кишечник, поэтому случаи развития псевдомембранозного колита крайне редки.
Клостридии по ходу своей жизнедеятельности выделяют токсичные вещества, которые пагубно влияют на эпителиальные клетки слизистой кишечника, буквально разрушая их.
Предрасполагающими факторами к развитию ПК считаются:
- пожилой возраст пациента;
- тяжелые сопутствующие патологии (онкозаболевания, почечная недостаточность, СПИД);
- бесконтрольный прием антацидных препаратов;
- самолечение с помощью антибактериальных лекарственных средств;
- использование клизм;
- патологии ЖКТ: болезнь Крона, язвенный колит;
- недавние операции любой локализации;
- питание через зонд;
- длительное лечение любого недуга в условиях стационара.
Псевдомембранозный колит у детей
Для новорожденных и детей первого года жизни характерна высокая степень распространенности бессимптомного бактерионосительства Clostridium difficile (до 50%). При этом развитие псевдомембранозного колита у детей этой возрастной группы происходит крайне редко, даже на фоне длительной антибиотикотерапии. Своеобразная невосприимчивость детей первого года жизни объясняется возрастными особенностями строения слизистой оболочки толстого кишечника, а также наличием в крови антител, полученных от матери.
Категорию риска составляют:
- Пациенты с выраженной лейкопенией (недостатком лейкоцитов) при лейкозах.
- Младенцы, страдающие болезнью Гиршпрунга.
- Дети с хроническими неспецифическими воспалительными заболеваниями кишечника (неспецифический язвенный колит, болезнь Крона).
Как правило, псевдомембранозный колит у детей развивается при длительном пребывании в стационаре на фоне антибиотикотерапии, однако описаны случаи возникновения заболевания у детей, выписанных из стационара через две недели после отмены антибиотиков. Их использование в амбулаторных условиях также может привести к развитию псевдомембранозного колита у детей. Заболевание начинается остро, и протекает в форме нетяжелого колита. Исключение составляют ослабленные дети с тяжелыми сопутствующими заболеваниями.

Характерной особенностью клинической картины псевдомембранозного колита у детей является отсутствие выраженных симптомов интоксикации, так что ведущее место занимает диарейный синдром (частый жидкий стул), нередко приводящий к угрожающей жизни дегидратации (обезвоживанию). В некоторых случаях большая часть каловых масс представлена густой массой отделившихся фибринозных наложений. При тяжелом течении возможны осложнения в виде профузных кишечных кровотечений, перфорации кишечника с развитием перитонита и сепсиса.
Симптомы и признаки
Клиническая картина при псевдомембранозном колите кишечника зависит от тяжести заболевания. Основной симптом – это диарея, остальные признаки проявляются по-разному при каждой форме:
Легкий тип отмечается незначительными болевыми ощущениями в животе, не имеет ярко выраженной картины, характерной именно для такой патологии. Симптомы похожи на простое расстройство функций кишечника. Понос бывает не чаще пяти раз в день, после отмены антибиотиков состояние улучшается. Кроме восстановления микрофлоры дополнительно лечить больного не требуется.
Во время протекания колита в средней форме диарея сопровождается слизистыми и кровяными выделениями. Незначительная боль в спокойном состоянии усиливается перед каждым опорожнением. Пациент страдает от многократных позывов и вздутия живота. Мочеиспускание становится редким, выделяемая жидкость приобретает насыщенный коричневый оттенок.
Признаки колита при псевдомембранозной форме тяжелого типа характерны сопутствующим нарушением работы сердечно-сосудистой системы. В стуле практически сразу выделяется кровь, падает давление, и начинается тахикардия. Также симптомами являются обезвоживание, приступы онемения конечностей, обусловленные электролитным сбоем и нарушение белкового обмена. При сильных болях наступает перфорация кишечника, повышается температура.
У ребенка до года заболевание развивается крайне редко, что связано со строением слизистой кишечника и грудным вскармливанием. Новорожденные получают антитела с молоком матери. Но в некоторых случаях ребенок может являться носителем вируса. Что касается клинической картины, отмечают, что при псевдомембранозном колите симптомы у детей бывают такие:
Диарея в легкой форме без других видимых признаков. Колит кишечника протекает без лихорадки и интоксикации. Болезненность в животе появляется при пальпации, дефекация умеренно-учащенная, не приводящая к потере водного баланса.
У ребенка старшего возраста клиническая картина является более выраженной: отказ от еды, вздутие живота. Каловые массы выходят с густой слизью и фиброзными фрагментами.
У ослабленных детей симптомы колита появляются на фоне лейкемии, хронического воспаления кишечника, врожденных патологий. В этом случае наступает нарушение кровообращения и развитие перитонита, что в комплексе с другими недугами вылечить сложнее, поэтому важно предусмотреть своевременную профилактику заболевания.
При подозрении на псевдомембранозный колит кишечника в первую очередь подвергают исследованию кал пациента на наличие клостридий и их токсинов.
Диагностика
При первичном обращении в медицинское учреждение врач обязательно проводит опрос больного, чтобы уточнить, что именно его беспокоит, когда проявились первые симптомы патологии, употреблял ли он до этого какие-либо лекарственные средства. Также осуществляется физикальный осмотр и измеряется уровень АД. После данных манипуляций назначается лабораторно-инструментальная диагностика, которая включает в себя следующие методики:

- анализ крови общеклинический;
- анализ урины общеклинический;
- посев каловых масс;
- биохимию крови;
- биопсию;
- МРТ или КТ поражённого органа;
- ирригоскопию с применением контрастного вещества;
- колоноскопию и ректороманоскопию – наиболее информативные диагностические методики, которые позволяют оценить степень поражения кишечника.
После получения всех результатов анализов и обследований доктор сможет назначить наиболее эффективную тактику лечения.
Подбор медикаментов при лечении псевдомембранозного энтероколита
Основная цель врачей – выявить и уничтожить инфекцию в кишечнике, провести профилактику, чтобы не допустить рецидива. Все меры сводятся к устранению провоцирующего фактора. Лечение псевдомембранозного колита начинается с отмены лекарственного средства, которое послужило причиной недуга, что бывает достаточно при легкой форме. Дальнейшая терапия подразумевает прием медикаментов, способных оказать губительное влияние на клостридии:
- Препарат, обладающий проникающими свойствами и достигающий нужной концентрации в клетках – Метронидазол. Лекарство взаимодействует с ДНК организма, ингибирует синтез нуклеина, что обеспечивает гибель патогенов. Назначается для лечения перорально и внутривенно, противопоказан детям до 12 лет. Рекомендовано осторожное применение в период беременности.
- Ванкомицин предназначен для борьбы со стафилококками, стрептококками и клостридиями. Способен изменять проницаемость клеточных мембран, активно действует только на микроорганизмы в стадии размножения. Плохо всасывается при приеме внутрь, поэтому назначают внутривенно, капельно. Не подходит для лечения от колита беременных и в период кормления грудью.
- Бацитрацин – препарат, основанный на штаммах бактерий. По спектру антимикробной активности близок к пенициллину, успешно подавляет граммположительные инфекции. В качестве антисептика для кишечника средство вводят внутривенно.
- У больных тяжелой формой колита после антибиотиков лечение заключается в коррекции белкового обмена и восстановлении электролитного баланса. Консервативная терапия подразумевает применение 15 литров инфузии на протяжении двух суток. Пациенту вводят раствор хлоридов натрия, калия, кальция и лактат натрия. Процедура проводится под постоянным контролем артериального давления и количества выделяемой мочи.
- Некоторые запущенные формы лечат только хирургическим вмешательством, когда необходимо полное удаление ободочной кишки.
Коррекция дисбактериоза при псевдомембранозном колите

Лечение дисбактериоза при псевдомембранозном колите относится к этиотропной терапии. Такую терапию назначают при всех формах течения заболевания для нормализации функции кишечника, и предотвращения рецидивов. Показаны длительные курсы (20-25 дней) бактериальными препаратами, такими как колибактерин, бифидумбактерин и бификол. При этом дозировка должна быть в два раза выше, чем в случае лечения обычного дисбактериоза (до 10 доз два раза в день). Терапию дисбактериоза назначают сразу же после окончания курсов антибактериальной терапии, а если противомикробные препараты не назначались — то сразу после нормализации стула.
Патогенетическая терапия
Патогенетическим лечением называется терапия основных синдромов заболевания. При псевдомембранозном колите необходимо проводить лечение дегидратационного синдрома (обезвоживания организма), коррекцию нарушений белкового и электролитного обмена и дезинтоксикационную терапию (лечение общего отравления организма). При тяжелом обезвоживании назначают парентеральное (внутривенное) введение растворов Рингера, Гартмана, лактосола.
Введение растворов осуществляют под контролем диуреза (снижение объема мочи свидетельствует о степени обезвоживания). В некоторых случаях приходится вводить до 8 литров регидратационных растворов в сутки. При тяжелом течении псевдомембранозного колита происходят значительные потери белка, которые восполняют внутривенным введением раствора альбумина или человеческой плазмы. Если выраженная диарея привела к нарушению электролитного обмена, то после восстановления нормального диуреза под контролем ионограммы вводятся растворы хлорида калия.
Для снижения интоксикационного синдрома показано назначение внутрь холестирамина. Этот препарат связывает токсины бактерий, и выводит их из организма. Однако следует помнить, что холестирамин резко снижает эффект пероральной антибактериальной терапии, поэтому его назначают либо в тяжелых случаях — когда метронидазол вводится внутривенно, либо при относительно легком течении псевдомембранозного колита — когда антибактериальная терапия не проводится.
Симптоматическая терапия
При псевдомембранозном колите строго противопоказано использование симптоматических антидиарейных препаратов, подавляющих перистальтику кишечника (Имодиум и т.п.), поскольку они могут усугубить интоксикацию и спровоцировать развитие такого серьезного осложнения, как токсическое расширение кишечника.
Хирургическое лечение
Хирургическое лечение псевдомембранозного колита проводят при развитии таких осложнений, как токсическое расширение кишечника и прободение кишки. Другим показанием к хирургическому вмешательству является крайне тяжелое течение заболевания. Так, если на протяжении двух суток интенсивная терапия не дает выраженных позитивных результатов, обращаются к хирургическим методам.
В случаях, когда состояние больного катастрофически ухудшается, несмотря на все предпринимаемые мероприятия, выжидательная тактика недопустима, поскольку летальный исход при таком течении заболевания может наступить очень быстро. Таким образом, при молниеносной форме псевдомембранозного колита к хирургическому лечению обращаются в 45-65% случаев (по разным данным). Чаще всего прибегают к колонэктомии с формированием илеостомы (удаление толстого кишечника с выводом конечного отрезка тонкой кишки на переднюю брюшную стенку).
Как правило, после проведения операции общее состояние пациентов улучшается, и появляется шанс на выздоровление. Между тем, летальность после операций при псевдомембранозном колите остается высокой (от 25 до 75% по разным источникам). Такая высокая смертность объясняется тяжелым исходным состоянием многих пациентов (пожилые люди с тяжелыми соматическими заболеваниями) и, в отдельных случаях, запоздалым проведением оперативного вмешательства.
После стабилизации состояния совершают второй этап операции, формируя анастомоз (соединение) между тонким кишечником и культей прямой кишки. При тяжелом течении заболевания пластика показана не ранее, чем через 3-6 месяцев после первого этапа операции.
Диета
Питание – это важная часть лечения псевдомембранозного энтероколита. При сильном поносе врачи рекомендуют ребенку голодание в течение 2 суток. Допускается питье воды и отвара шиповника. Постепенно в питание добавляется обезжиренный кефир, несладкий кисель. По мере восстановления функциональности кишечника больным разрешается употреблять:
- рис;
- слизистые крупяные отвары;
- печеный картофель;
- тефтели, котлеты из нежирного мяса (птицы);
- паровые омлеты.

Питание должно быть дробным небольшими порциями по 6 раз/день. Диета при псевдомембранозном колите включает в себя полный отказ от фруктов и овощей. Лишь при улучшении состояния разрешено их запекать или отваривать (все, кроме капусты).
Запрещенные продукты во время лечения колита у детей:
- жирные, копченые, жареные блюда;
- специи, приправы;
- шоколад, кофе, какао;
- кондитерские изделия;
- консервы, маринады;
- полуфабрикаты, концентрированные соки, газированные напитки.
Осложнения псевдомембранозного колита
Токсическая дилатация толстой кишки (токсический мегаколон).
Предполагается, что токсическая дилатация связана с повышением концентрации оксида азота — ингибитора сократительной активности гладкой мускулатуры.
При развитии токсического мегаколона отмечается повышение температуры тела более 38,5°С, резкая и быстро нарастающая слабость, адинамия, потеря массы тела, частый жидкий стул с обильным выделением крови, гноя, боль в животе. Тахикардия более 90 ударов в 1 мин. Артериальная гипотония. Олигурия.
Живот — болезнен, вздут, кишечные шумы ослаблены.
Дилатация толстой кишки подтверждается рентгенологически (диаметр кишки более 6 см). В клиническом анализе крови отмечается нейтрофильный лейкоцитоз (более 10 х 10 9/л).
При токсическом мегаколоне высок риск развития перфорации толстой кишки.
Перфорация толстой кишки.
У больного значительно усиливаются боли, появляется локальная болезненность и напряжение мышц брюшного пресса, определяется свободная жидкость в брюшной полости, еще более усугубляются общие расстройства.
Тяжёлый синдром мальабсорбции .
Истощение, отёки, асцит.
Обезвоживание, связанное со значительной потерей жидкости при диарее, что приводит к выраженному падению давления (гипотензии).
Почечная недостаточность, возникающая в результате обезвоживания.
Снижение количества калия в крови (гипокалиемия), что обусловлено диареей.

Профилактические мероприятия
Профилактика ПК основана на рациональном и корректном назначении антибактериальных препаратов строго по показаниям и с учетом всех противопоказаний. Также очень важно назначение соответствующих бактериальных препаратов, предназначенных для коррекции кишечного дисбактериоза особенно после длительного приема антибиотиков.
В группе повышенного риска находятся пожилые пациенты и пациенты, длительно принимающие препараты-антагонисты Н2-гистаминовых рецепторов (всем известный, ранитидин). Таким пациентам крайне нежелательно принимать антибиотики группы линкозамиды (линкомицин, клиндамицин и другие), полуискусственных пенициллинов (ампициллин), тетрациклинов, левомицетин и антибиотики цефалоспоринового ряда.
Важно вовремя подавлять вспышки инфекции в условиях больницы. Однако нужно учесть, что клостридии крайне устойчивы к влиянию обычных дезсредств. В домашних условиях очень важно соблюдать правила личной гигиены и пользоваться только одноразовыми принадлежностями. Такого больного нужно изолировать от здоровых членов семьи.
Псевдомембранозный колит

Каждое достижение в медицине имеет свою цену Ричард К. Рут Слева бело-желтые бляшки в сигмовидной кишке, справа — сливающиеся бляшки, образующие псевдомембранозные поля в ободочной кишке Этиология Бактерии Clostridiulm difficil
#02-03/99 Ключевые слова / keywords: Гастроэнтерология, Gastroenterology
1999-02-24 00:00
52773 прочтения
Каждое достижение в медицине имеет свою цену
Ричард К. Рут
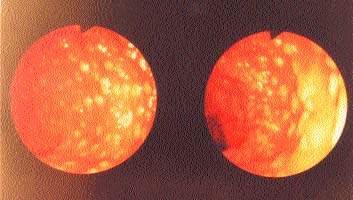 |
| Слева бело-желтые бляшки в сигмовидной кишке, справа — сливающиеся бляшки, образующие псевдомембранозные поля в ободочной кишке |
- Этиология
Бактерии Clostridiulm difficile (КД) являются достаточно крупными (от 0,5-1,9 до 3,0-16,9 мкм) подвижными грамположительными бактериями, относящимися к группе облигатных анаэробов (род Clostridiulm), образующих в неблагоприятных условиях овальные субтерминальные споры, которые устойчивы к нагреванию и способны к длительному (в течение нескольких лет) переживанию в аэробных условиях. Температурный оптимум роста вегетативных форм — 30-37ОС. Важнейшими факторами патогенности КД являются энтеротоксин А и цитотоксин В.
КД широко распространены в природе и имеют убиквитарное распространение, поскольку являются постоянными обитателями кишечника многих видов животных (домашних и диких), а в некоторых случаях могут обнаруживаться в испражнениях здоровых людей различных возрастных групп, включая новорожденных. В результате контаминации почвы КД могут обнаруживаться на различных объектах внешней среды, что представляет особую проблему в медицинских учреждениях. Несмотря на то что КД не относятся к патогенным бактериям, тем не менее в определенных условиях они способны вызывать такие заболевания, как антибиотикоопосредованные диареи (АОД) и псевдомембранозный колит (ПМК). Обнаружение КД на объектах внешней среды стационаров создает серьезную угрозу инфицирования пациентов. Хотя риск инфицирования при прямом контакте с бактериовыделителем или больным, как правило, невелик, однако длительный контакт может привести к развитию клинически манифестных форм инфекций, обусловленных КД (ИКД). В литературе имеются многочисленные описания внутрибольничных вспышек АОД в отделениях различного профиля [9], в том числе гериатрических, ортопедических, хирургических и пр., что позволяет говорить об ИКД как о нозокомиальной инфекции. Теоретически в отделениях любого профиля может быть зарегистрирована вспышка ИКД, однако наблюдения показывают, что наибольшему риску инфицирования КД подвергаются больные хирургических отделений и палат интенсивной терапии [7, 10]. Достаточно четко прослеживается следующая закономерность: чем более интенсивно используются инвазивные методы диагностики и лечения и агрессивная терапия, тем выше риск развития ИКД. Как показывают эпидемиологические исследования, удельный вес внутрибольничных инфекций, обусловленных КД, постоянно растет, особенно в тех странах, где налажена соответствующая лабораторно-диагностическая база [4].
Контролировать ситуацию с внутрибольничным инфицированием пациентов КД достаточно сложно. Во-первых, контроль за обсемененностью спорами КД объектов внешней среды в стационарах не проводится, во-вторых, споры КД резистентны к действию стандартных дезсредств.
Как показывают наблюдения, от 3 до 6% здоровых людей являются носителями КД. Здоровые дети первого года жизни, в том числе и новорожденные, являются носителями КД гораздо чаще — в 30-90%, хотя развитие ПМК в данной возрастной группе нетипично. В стационарах частота выявления бактерионосителей КД может быть выше. При этом у бактерионосителей, как правило, отсутствуют какие-либо клинико-лабораторные указания на развитие ИКД в анамнезе.
Сам по себе факт инфицирования пациентов КД не является определяющим в развитии ИКД. Условиями, необходимыми [4] для развития ИКД, в том числе и ПМК, являются:
- наличие источника инфицирования;
- оральный прием антибиотиков или других групп препаратов, способных вызвать нарушение микробиоценоза кишечника;
- колонизация слизистой толстой кишки КД и выработка экзотоксинов;
- индивидуальные факторы риска: возраст, предшествующие заболевания и госпитализации, длительность заболевания.
Критическим фактором для развития ИКД, в том числе и ПМК, является снижение колонизационной резистентности кишечника, в частности толстой кишки, как следствие нарушения микробиоценоза. Особенность микробной экологии толстой кишки — это абсолютное доминирование в ней анаэробных бактерий, находящихся в соотношении с аэробами 1000:1 и плотностью популяции около 1012 микробных тел на 1 г фекалий. Несмотря на столь высокий популяционный уровень индигенной микрофлоры в толстой кишке, данный микробиоценоз легко нарушается, особенно под действием антибиотиков или других внешних факторов, а восстанавливается исключительно медленно [1, 2].
| Псевдомембранозный колит (ПМК) — это редкое, но опасное заболевание, вызывающееся спорообразующим анаэробным микробом Clostridiulm difficile. Несмотря на то что клинические проявления ПМК весьма вариабельны, чаще всего у больных наблюдаются длительная диарея, интоксикация, боль в животе и лейкоцитоз, возникающие, как правило, на фоне антибиотикотерапии |
Важнейшим и наиболее мощным ко-фактором, способствующим развитию ИКД, является использование антибиотиков. Антибиотикотерапия предшествует развитию ПМК в 60-85% случаях. Несмотря на то что ИКД может быть спровоцирована практически любыми антибиотиками и/или антимикробными препаратами, включая сульфаниламиды и метронидазол, чаще всего развитие ИКД отмечается на фоне приема цефалоспоринов III поколения, клиндамицина, ампициллина, амоксициллина с клавулановой кислотой, фторхинолонов. Макролиды и рифампицин достаточно редко выступают в роли ко-факторов в развитии ИКД. Следует помнить, что ни доза, ни кратность, ни даже способ введения препарата не влияют на возможность развития ИКД. Были случаи, когда даже однократное введение антибиотика приводило к развитию АОД и ПМК.
Кроме того, описаны случаи развития ИКД, в том числе и ПМК, при использовании химиотерапии, антинеопластических препаратов, иммуносупрессивной терапии, препаратов золота, нестероидных противовоспалительных средств, антидиарейных препаратов, нейролептиков. Нарушение микроэкологии кишечника, сопровождающееся колонизацией КД, встречается при обширных операциях на брюшной полости, длительном использовании назогастральных зондов и клизм, у пациентов реанимационных отделений и отделений интенсивной терапии, при почечной недостаточности и некоторых других состояниях.
Практика показывает, что особенно часто ИКД выявляется в хирургических стационарах, особенно у больных, перенесших операцию на кишечнике. Данное обстоятельство может иметь только одно объяснение: помимо того что обширные хирургические операции сами по себе могут способствовать развитию ИКД, такие больные более чем в 90% получают антибиотики широкого спектра действия, как с целью лечения, так и профилактики. И все же примерно у 10-11% хирургических больных ИКД развивается без предварительного приема антибиотиков.
Исследования канадских авторов [3] показали, что наиболее серьезную проблему АОД представляют в больницах с числом коек более 200, в которых уровень заболеваемости ИКД составляет от 30,8 до 40,3 случая на 100 тыс. больных. Согласно другим наблюдениям [10], ПМК развивается у амбулаторных больных при получении оральных антибиотиков с частотой один-три случая на 100 тыс. больных, а среди госпитализированных частота развития ПМК составляет один на 100 (в зависимости от профиля стационара).
Таким образом, многие исследователи заключают, что КД является ведущим клинически значимым патогеном, ответственным за развитие нозокомиальных диарей, на долю которых приходится от 20 до 45% всех внутрибольничных диарей [8].
Хотя КД могут обнаруживаться в стуле здоровых людей, имеются убедительные данные, свидетельствующие о том, что эти микроорганизмы не способны к длительному существованию в неизмененной нормальной микроэкосистеме кишечника. Фактором, способствующим колонизации КД толстой кишки, является глубокое угнетение анаэробной части индигенной микрофлоры кишечника.
Ведущими факторами патогенности КД являются токсические субстанции, вырабатываемые КД: токсин А (ТА) и токсин В (ТВ), которые in vivo проявляют синергизм действия [6]. ТА — это мощный энтеротоксин с цитотоксической активностью, вызывающий нарушение барьерной функции слизистой кишечника за счет повреждения эпителиоцитов и активацию секреции жидкости в просвет кишечника. ТВ — в 1000 раз более мощный цитотоксин, чем ТА, однако его цитотоксический эффект обусловлен нарушением полимеризации внутриклеточных филаментов актина. Пикограмм ТВ способен оказывать цитопатический эффект. Выявляемые в толстой кишке морфологические изменения слизистой обусловлены действием только токсинов, поскольку сами КД не обладают инвазивными свойствами и, как правило, в подслизистый слой не проникают. Протяженность и глубина морфологических изменений, выявляемых в толстой кишке, обусловливают тяжесть течения инфекционного процесса.
Несмотря на то что ИКД чаще всего развивается после лечения антибиотиками, тем не менее взаимодействие между защитными факторами организма, внешней средой и КД остается в значительной степени мало изученным, в силу чего многие стороны патогенеза до сих пор не ясны.
Спектр клинических проявлений ИКД варьирует в широких пределах: от бессимптомного носительства и самокупирующейся диареи до тяжелых колитов. Так как ПМК представляет собой крайнюю форму проявления ИКД с возможным рецидивирующим течением, часто неблагоприятным прогнозом и требует особо сложного лечения, наибольшее внимание врачи уделяют именно этой форме заболевания. В табл. 1 представлены факторы риска развития колита, обусловленного КД.
Таблица 1. Факторы риска развития колита, обусловленного КД
- Возраст старше 65 лет
- Почечная недостаточность
- Хронические обструктивные заболевания легких
- Злокачественные новобразования
- Прием блокаторов Н2 гистаминовых рецепторов
- Поступление больных из других стационаров
- Пребывание больного в отделении интенсивной терапии
Средний возраст заболевших составляет 58-60 лет, хотя развитие ИКД принципиально не зависит от возраста больных [5]. Исключение составляют новорожденные и дети до года, у которых развитие ИКД является нетипичным, и это несмотря на то, что частота обнаружения в кишечнике токсигенных штаммов КД у них намного выше, чем у взрослых. Парадокс данной ситуации объясняется тем, что в данной возрастной группе в кишечном эпителии отсутствуют рецепторы для токсинов КД.
Для АОД характерно развитие диарейного синдрома (ДС) на фоне антибиотикотерапии, при этом общее состояние больных, как правило, не изменяется. Температура тела остается на исходном уровне, могут беспокоить небольшие боли в животе, стул умеренно водянистый. Диарейный синдром носит непродолжительный характер и купируется в течение одного-трех дней после прекращения антибиотикотерапии без дополнительного лечения. Установить истинное число больных с АОД, обусловленными КД, достаточно трудно, поскольку это состояние протекает легко, без выраженного обезвоживания и, как правило, заканчивается спонтанным выздоровлением.
Клиническая картина ПМК весьма вариабельна, поскольку данное заболевание осложняет течение основного патологического процесса. Типичными для ПМК являются жидкий стул, боль в животе и лихорадка. Степень выраженности этих признаков может широко варьировать. ПМК развивается, как правило, либо непосредственно на фоне проводимой антибиотикотерапии, либо через семь — десять дней (в редких случаях позже) после прекращения антибиотикотерапии.
Таблица 2. Факторы риска развития рецидивирующего течения ПМК
- Наличие в анамнезе предшествующих эпизодов диарей, обусловленных КД
- Заболевания, обусловленные 1 или 2 типом штамма КД
- Длительные курсы антибиотикотерапии в анамнезе при лечении других инфекционных заболеваний
- Женский пол
- Начало заболевания весной
В клинической картине ПМК доминирует ДС, который в отдельных случаях бывает единственным проявлением заболевания. ДС, будучи наиболее постоянным клиническим признаком ПМК, в дебюте заболевания выявляется в 100% случаев. В отдельных случаях манифестация заболевания может начинаться с лихорадки. Частота дефекаций в сутки достигает пяти и более раз, доходя иногда до 20-30. Стул, как правило, водянистый, небольшого объема, но, учитывая кратность дефекаций, у больных могут развиваться водно-электролитные расстройства разной степени выраженности. Диарея носит упорный характер и может сохраняется до восьми — десяти недель. В отдельных случаях расстройство стула может носить перемежающий характер, когда диарея сменяется оформленным стулом, сохраняющимся в течение одного-двух дней. Часто стул содержит примесь слизи, тогда как примесь крови не характерна. Рвота встречается достаточно редко и выявляется в более поздние сроки заболевания, свидетельствуя о тяжести его течения.
Фактически одновременно с ДС у больных выявляются боли в животе разной интенсивности, преимущественно спастического характера, которые усиливаются при пальпации живота. Чаще всего боль не имеет четкой локализации и определяется по ходу кишечника.
В большинстве случаев температура тела у больных с ПМК держится на фебрильных цифрах, однако в последние годы участились случаи заболевания, при которых регистрируется гектическая лихорадка, превышающая 40°С.
Характерным для ПМК является достаточно выраженный лейкоцитоз периферической крови, достигающий 15х109/л, а в ряде случаев выявляются даже лейкемоидные реакции, при которых количество лейкоцитов может достигать 40х109/л. Имеются отдельные наблюдения, когда ПМК у больных развивается на фоне лейкопении. Как правило, лейкопения регистрируется у больных, получавших химиотерапию по поводу злокачественных опухолей. ПМК у таких больных протекает исключительно тяжело и часто носит фульминантное течение с развитием бактериемии. Именно фульминантное течение ПМК представляет наибольшую трудность в плане диагностики в силу необычности выявляемой клинической симптоматики, поскольку в этом случае наблюдается комбинированное поражение толстого и тонкого кишечника.
Для фульминантного течения ПМК характерно быстрое прогрессирование процесса. ДС, являющийся ключевым для АОД при фульминантном течении ПМК, может отсутствовать. Почти у половины больных регистрируются запор и признаки кишечной непроходимости. У таких пациентов выявляются признаки “острого живота”, лихорадка бывает выше 38,4ОС [9]. При компьютерной томографии брюшной полости выявляется асцит и значительное утолщение стенки толстой кишки. Несмотря на отчетливые клинические признаки “острого живота”, свободный воздух в брюшной полости не определяется. Особенностью ведения таких больных является то, что базисная медикаментозная терапия оказывается малоэффективной и требуется радикальное хирургическое вмешательство (субтотальная колэктомия). Летальность при фульминантном течении ПМК достигает 58%.
Учитывая длительный и упорный характер диареи, у больных с ПМК часто выявляются тяжелые электролитные расстройства (гипокалиемия), гиповолемия, снижение плазменного уровня альбуминов, развитие отеков вплоть до анасарки, гипотензия.
ПМК может осложняться развитием токсического мегаколона, перфорацией толстой кишки с развитием перитонита, инфекционно-токсическим шоком.
Рецидивирующее течение ПМК наблюдается в 20% у больных с первично установленным диагнозом после проведения стандартной антибиотикотерапии. Для больных, у которых выявлен хотя бы один рецидив, риск рецидивирующего течения ПМК возрастает до 45-68%. Механизм формирования рецидивирующего течения ПМК до сих пор до конца не выяснен. Полагают, что основной причиной является неполная санация кишечника от спор КД, хотя не исключается возможность реинфицирования.
Факторы риска развития рецидивирующего течения ПМК представлены в табл. 2.
Диагностика ИКД — это сложная проблема. Выделение возбудителя хоть и представляется важным, но имеет второстепенное значение в связи с медленным ростом бактерий. Важнейшим методом верификации диагноза ПМК является обнаружение токсинов КД в стуле. Токсигенные штаммы КД, вызывающие развитие ПМК, вырабатывают, как правило, оба токсина, однако “золотым стандартом” в диагностике ПМК может служить обнаружение ТВ при тестировании культуры клеток, которое представляет собой наиболее чувствительный метод. Предлагаемые коммерческие наборы ИФА по обнаружению токсинов А и В, к сожалению, уступают по специфичности и чувствительности цитотоксическому тесту. В последние годы разрабатываются методы ПЦР как альтернатива цитотоксическому тесту. Как показывают многие исследования, латекс-агглютинация, используемая для диагностики ИКД, на сегодня не может быть рекомендована как “базовый” метод диагностики, поскольку обладает достаточно низкой чувствительностью.
Не утратили своего диагностического значения эндоскопические методы. Патологические изменения локализуются преимущественно в дистальном отделе толстой кишки, и для их выявления достаточно провести сигмоидоскопию, однако у одной трети больных патологические изменения локализуются только в проксимальной части толстой кишки; в этом случае требуется проведение колоноскопии. Тонкий кишечник также может вовлекаться в патологический процесс, однако данный факт выявляется только на аутопсии. При сигмоидоскопии и колоноскопии отмечают диффузную гиперемию и отечность слизистой кишечника с утолщением стенки кишки, хотя в стенке кишки выявляется незначительная воспалительная реакция, а в подслизистом слое — скопление лимфоцитов. На поверхности обнаруживают характерные фибринозные бляшки желтовато-белого цвета в диаметре от 2 мм до 2 см и более (см. рис.), покрывающие язвы слизистой кишечника. Эти бляшки могут сливаться, образуя псевдомембранозные поля. Псевдомембраны обнаруживаются между прямой кишкой и левым изгибом ободочной кишки, но может поражаться и поперечная ободочная кишка. Гистологическое исследование показывает, что бляшки состоят из фибрина, муцина, слущенных эпителиальных клеток, разрушенных лейкоцитов и микробной флоры толстого кишечника.
Характер и объем проводимых терапевтических мероприятий у больных с ИКД определяется клиническим вариантом заболевания.
Асимптоматическое носительство, как правило, не требует специальных методов лечения.
При установлении диагноза ПМК лечение начинают незамедлительно. Прежде всего, если заболевание развилось на фоне антибиотикотерапии, необходима ее отмена.
Проводимая больным ПМК терапия преследует две основные цели: во-первых, необходимо купировать воспалительный процесс в кишечнике и, во-вторых, санировать кишечник от спор КД [4, 10].
Несмотря на то что антибиотики чаще всего служат причиной развития ИКД, именно антибактериальная терапия является неотъемлемой частью стандартной базисной терапии ПМК, проведение которой ограничивает колонизацию кишечника КД и купирует воспалительные изменения в кишечнике.
КД in vitro проявляют различную чувствительность к антибиотикам, однако наиболее стабильная чувствительность наблюдается к ванкомицину и метронидазолу. Обязательным условием проведения этиотропной терапии у больных с ПМК является энтеральное введение антибиотиков, поскольку при парентеральном их введении в кишечнике не создается достаточной концентрации и санации организма не наступает.
Несмотря на то что ванкомицин обычно назначают в дозе по 500 мг, проведенные исследования показывают, что дозы 125 мг четыре раза в день бывает вполне достаточно для купирования воспаления. В силу ограниченной доступности ванкомицина более широко используется метронидазол, который назначается в дозе 250–500 мг три-четыре раза в сутки. Оральный прием метронидазола в большинстве случаев эквивалентен ванкомицину, который предпочтителен в тяжелых случаях ПМК. Курс лечения антибиотиками составляет 10 дней. Если невозможен оральный прием препаратов, их вводят через назогастральный зонд. В редких случаях, при тяжелом течении ПМК, возможно комбинированное назначение ванкомицина (per rectulm) и метронидазола (внутривенно), но следует помнить, что внутривенное введение препаратов менее эффективно.
В качестве базисной антибактериальной терапии может использоваться и бацитрацин, однако в силу вариабельности и нестабильности фармакологического эффекта на КД предпочтение отдают метронидазолу и ванкомицину.
| Патоморфологические изменения при ПМК выявляются преимущественно в толстой кишке и характеризуются диффузной гиперемией, а также отечностью слизистой кишечника с утолщением стенки кишки и образованием характерных фибринозных налетов в виде бляшек желтовато-белого цвета |
Базисная антибактериальная терапия способствует достаточно быстрому купированию клинических проявлений заболевания: нормализация температуры наступает, как правило, уже в течение 24–48 часов, а частота и характер стула восстанавливается на 1–13-й день (в среднем 4,5 дня).
Были случаи, когда при неэффективности антибактериальной терапии у больных с ПМК использовался нормальный человеческий иммуноглобулин (ИГ) для внутривенного введения в дозе 200-300 мг/кг веса. Основанием для назначения данного препарата явились контрольные исследования, показавшие, что препараты ИГ содержат антитела против ТА и ТВ в концентрации 0,4-1,6 мг/мл IgG. На фоне проводимой терапии у больных регистрируется быстрое прекращение диареи, купирование болей в животе и нормализация температуры.
К сожалению, какой бы курс антибиотиков нами ни использовался, ни один из них не гарантирует полную санацию кишечника от спор КД, что создает угрозу для развития рецидивирующего течения ПМК [2]. Доказана высокая эффективность препаратов на основе непатогенных дрожжей Saccharomyces boulardii (СБ) для санации организма от спор КД. На основании большого количества наблюдений можно сделать вывод, что терапевтический эффект СБ проявляется как при сочетанном их назначении с антибиотиками, так и при проведении самостоятельного курса после антибиотикотерапии. Механизм действия СБ до конца не выяснен. Установлено, что они ингибируют рост КД, уменьшают образование и накопление цитотоксина в кишечнике, ингибируют кишечные эффекты токсинов за счет протеолиза самих токсинов и ингибирования связывания токсинов с рецепторами. Наиболее высокая клиническая эффективность СБ установлена преимущественно у больных с рецидивирующим течением ПМК. Как показывают наблюдения, не следует использовать СБ при первом эпизоде ПМК. СБ назначают по 1 г в сутки в течение четырех недель.
Эффект от использования энтеросорбентов и ионообменных смол (например, холестирамина, холестипола), несмотря на их способность связывать токсины КД, многими клиницистами оценивается как весьма скромный.
У больных с фульминантным течением ПМК базисная терапия часто оказывается малоэффективной, поэтому в таких случаях проводят хирургическое лечение [9]. Абсолютным показанием к хирургическому лечению (колэктомия с илеостомой) является наличие признаков перитонита.
Литература
1. Бондаренко В. М., Учайкин В. Ф., Мурашова А. О., Абрамов Н. А. Дисбиоз. М., 1995.
2. Малов В. А., Бондаренко В. М., Пак С. Г. Роль Cloctridiuln difficile в патологии человека // Журн. микробиол.1996. № 1. С. 91-96.
3. Alfa M. J., Dul T., Beda G. Sulrvey of incidence of Clostridiulm difficile infection in Canadian hospitals and diagnostic approaches// J. Clin. Microbiol. 1998. V. 36. P. 2076-2080.
4. Bartlett J. G. Clostridiulm difficile: clinical consideretion // Rev. Infect. Dis. 1990. V. 12. Sulppl. 2. P. S243-S251.
5. Bolton R. P., Thomas D. F. Pseuldomembranouls colitis in children and adults // Br. J. Hosp. Med. 1986. V. 35. P. 37-42.
6. Branka J. E. et al. Early fulnctional effects of Clostridiulm difficile toxin A on hulman colonocytes // Gastroenterology. 1997. V .112. № 6. P. 1887-1894.
7. Bulstrode N.W. et al. Clostridiulm difficile colitis after aortic sulrgery // Eulr. J. Vasc. Endovasc. Sulrg. 1997. V. 14. № 3. P. 46-84.
8. Hulghes J. M., Jarvis W. R. Nosocomial gastrointestinal infection // In R. P. Wenzel (ed) Prevention and control of nosocomial infection. The Williams & Wilkins Co. Baltimore, 1987. P. 405-439.
9. Medich D. S., Lee K., Simmons R.L. et al. Laparotomy for fulminant pseuldomembranouls colitis // Arch. Sulrg. 1992. V .127. № 7. P. 847-852.
10. Stergachis A. Perara D. R., Schnell M. M. et al. Antibiotic-associated colitis // West. J. Med. 1984. V. 40. P. 217-219.
Историческая справка
ПМК впервые был описан американским хирургом J. Finney в 1893 году у молодой женщины, прооперированной по поводу опухоли пилорической части желудка. У пациентки развилась тяжелая диарея, повлекшая смерть на 15-й день. На аутопсии в кишечнике были обнаружены дифтеритические мембраны, что, собственно, и послужило основанием для введения данного термина. В “доантибактериальную эпоху” ПМК выявлялся у больных крайне редко и диагноз устанавливался только при аутопсии. С внедрением антибиотиков в повседневную клиническую практику проблема ПМК обострилась, поскольку количество таких больных резко возросло.
В 1965 году S. Goulstone и V. McGovern, анализируя анатомо-гистологические изменения, обнаруживаемые у больных с ПМК в кишечнике, высказали предположение, что данное заболевание вызывается неизвестным токсическим агентом, действующим локально. В 1969 году J. Small установил, что у лабораторных животных, получающих линкомицин гидрохлорид, развивается типичная патоморфологическая картина ПМК, что и явилось в последующих исследованиях лабораторной моделью изучения ПМК. R. Green в 1974 году выявил цитотоксичность в культуре клеток содержимого кишечника лабораторных животных, получавших антибиотики — это позволило предположить, что в развитии цитотоксического эффекта играет определенную роль неизвестный вирус. Установление зависимости развития диареи и/или колита на фоне использования антибиотиков послужило основанием для широкого использования в клинической практике термина “антибиотико-опосредованные диареи (колиты)”.
Несмотря на то что I. Hall и E. O’Toole впервые обнаружили Clostridiulm difficile в кишечном содержимом людей в 1935 году, их этиологическая роль в развитии ПМК и антибиотико-опосредованных диарей (АОД) была установлена только во второй половине 70-х годов.
Источник https://akonit-med.ru/articles/gastroenterologiya/17994-psevdomembranoznyj-enterokolit-chto-takoe-prichiny-i-lechenie.html
Источник https://www.lvrach.ru/1999/02-03/4527414
Источник