Фенилкетонурия ( Болезнь Феллинга , Фенилпировиноградная олигофрения )
Фенилкетонурия – это наследственное нарушение аминокислотного обмена, обусловленное недостаточностью печеночных ферментов, участвующих в метаболизме фенилаланина до тирозина. Ранними признаками фенилкетонурии служат рвота, вялость или гиперактивность, запах плесени от мочи и кожи, задержка психомоторного развития; типичные поздние признаки включают олигофрению, отставание в физическом развитии, судороги, экзематозные изменения кожи и др. Скрининг новорожденных на фенилкетонурию проводится еще в родильном доме; последующая диагностика включает молекулярно-генетическое тестирование, определение концентрации фенилаланина в крови, биохимический анализ мочи, ЭЭГ, МРТ головного мозга. Лечение фенилкетонурии заключается в соблюдении специальной диеты.
МКБ-10
E70.0 Классическая фенилкетонурия
- Причины фенилкетонурии
- Патогенез
- Симптомы фенилкетонурии
- Диагностика
- Лечение фенилкетонурии
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Фенилкетонурия (болезнь Феллинга, фенилпировиноградная олигофрения) – врожденная, генетически обусловленная патология, характеризующаяся нарушением гидроксилирования фенилаланина, накоплением аминокислоты и ее метаболитов в физиологических жидкостях и тканях с последующим тяжелым поражением ЦНС. Фенилкетонурия впервые описана А. Феллингом в 1934 г.; встречается с частотой 1 случай на 10 000 новорожденных.
В неонатальном периоде фенилкетонурия не имеет клинических проявлений, однако поступление фенилаланина с пищей вызывает манифестацию заболевания уже в первом полугодии жизни, а в дальнейшем приводит к тяжелым нарушениям развития ребенка. Именно поэтому пресимптоматическое выявление фенилкетонурии у новорожденных является важнейшей задачей неонатологии, педиатрии и генетики.

Фенилкетонурия
Причины фенилкетонурии
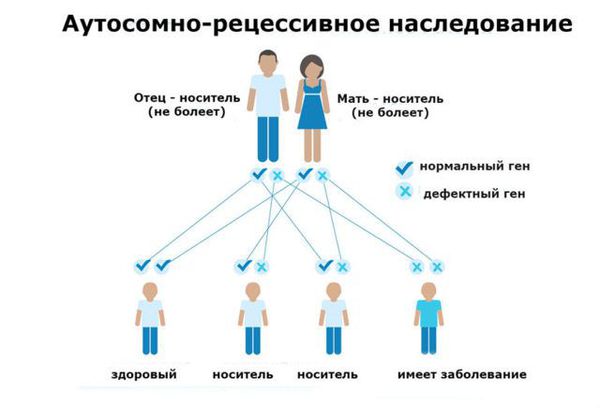
Фенилкетонурия является заболеванием с аутосомно-рецессивным характером наследования. Это означает, что для развития клинических признаков фенилкетонурии ребенок должен унаследовать по одной дефектной копии гена от обоих родителей, являющихся гетерозиготными носителями мутантного гена.
Чаще всего к развитию фенилкетонурии приводит мутация гена, кодирующего фермент фенилаланин-4-гидроксилазу и расположенного на длинном плече 12 хромосомы (локус12q22-q24.1). Это, так называемая, классическая фенилкетонурия I типа, составляющая 98% всех случаев заболевания. Гиперфенилаланинемия может достигать 30 мг% и выше. При отсутствии лечения данный вариант фенилкетонурии сопровождается глубокой умственной отсталостью.
Кроме классической формы, различают атипичные варианты фенилкетонурии, протекающие с той же клинической симптоматикой, но не поддающиеся коррекции диетотерапией. К ним относятся фенилкетонурия II типа (недостаточность дегидроптеринредуктазы), фенилкетонурия III типа (дефицит тетрагидробиоптерина) и другие, более редкие варианты. Вероятность рождения ребенка, больного фенилкетонурией, повышается при заключении близкородственных браков.
Патогенез
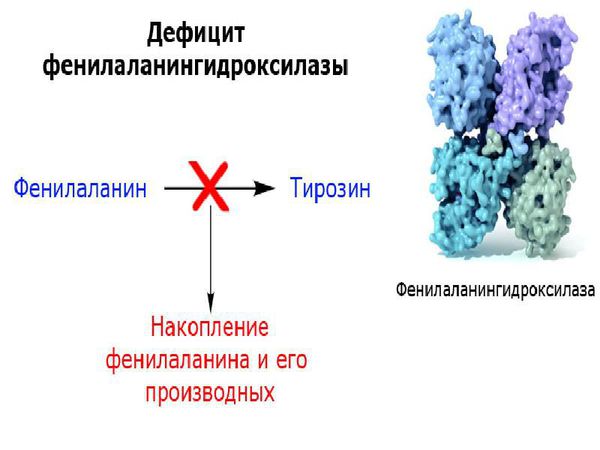
В основе классической формы фенилкетонурии лежит недостаточность фермента фенилаланин-4-гидроксилазы, участвующего в конверсии фенилаланина в тирозин в митохондриях гепатоцитов. В свою очередь, производный тирозина – тирамин является исходным продуктом для синтеза катехоламинов (адреналина и норадреналина), а дийодтирозин – для образования тироксина. Кроме этого, результатом метаболизма фенилаланина служит образование пигмента меланина.
Наследственная недостаточность фермента фенилалаиин-4-гидроксилазы при фенилкетонурии приводит к нарушению окисления фенилаланина, поступающего с пищей, в результате чего его концентрация в крови (фенилаланинемия) и спинномозговой жидкости значительно возрастает, а уровень тирозина соответственно падает. Избыточное содержание фенилаланина устраняется путем повышенной экскреции с мочой его метаболитов — фенилпировиноградной, фенилмолочной и фенилуксусной кислот.
Нарушение обмена аминокислот сопровождается нарушением миелинизации нервных волокон, снижением образования нейромедиаторов (дофамина, серотонина и др.), запускающими патогенетические механизмы задержки умственного развития и прогредиентное слабоумие.
Симптомы фенилкетонурии
Новорожденные с фенилкетонурией не имеют клинических признаков заболевания. Обычно манифестация фенилкетонурии у детей происходит в возрасте 2-6 месяцев. С началом кормления в организм ребенка начинает поступать белок грудного молока либо его заменителей, что приводит к развитию первых, неспецифических симптомов – вялости, иногда – беспокойства и гипервозбудимости, срыгивания, мышечной дистонии, судорожного синдрома. Одним из ранних патогномоничных признаков фенилкетонурии служит упорная рвота, которая нередко ошибочно расценивается как проявление пилоростеноза.
Ко второму полугодию становится заметным отставание ребенка в психомоторном развитии. Ребенок становится менее активным, безучастным, перестает узнавать близких, не пытается садиться и вставать на ножки. Аномальный состав мочи и пота обусловливают характерный «мышиный» запах (запах плесени), исходящий от тела. Часто наблюдается шелушение кожи, дерматиты, экзема, склеродермия.
У детей с фенилкетонурией, не получающих лечения, выявляется микроцефалия, прогнатия, позднее (после 1,5 лет) прорезывание зубов, гипоплазия эмали. Отмечается задержка речевого развития, а к 3-4 годам выявляется глубокая олигофрения (идиотия) и практически полное отсутствие речи.
Дети с фенилкетонурией имеют диспластическое телосложение, нередко — врожденные пороки сердца, вегетативные дисфункции (потливость, акроцианоз, артериальную гипотонию), страдают запорами. К фенотипическим особенностям детей, страдающих фенилкетонурией, следует отнести светлую кожу, глаза и волосы. Для ребенка с фенилкетонурией характерны специфическая поза «портного» (согнутые в суставах верхние и нижние конечности), тремор рук, шаткая, семенящая походка, гиперкинезы.
Клинические проявления фенилкетонурии II типа характеризуются тяжелой степенью умственной отсталости, повышенной возбудимостью, судорогами, спастическим тетрапарезом, сухожильной гиперрефлексией. Прогрессирование заболевание может приводить к гибели ребенка в возрасте 2-З лет. При фенилкетонури III типа развивается триада признаков: микроцефалия, олигофрения, спастический тетрапарез.
Диагностика
В настоящее время диагностика фенилкетонурии (а также галактоземии, врожденного гипотиреоза, адрено-генитального синдрома и муковисцидоза) входит в программу неонатального скрининга, осуществляемого всем новорожденным. Основные и дополнительные методы диагностики:
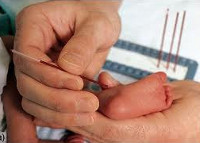
- Скрининг-тест. Проводится на 3-5 день жизни доношенного и 7 день жизни недоношенного ребенка путем забора образца капиллярной крови на специальный бумажный бланк. При обнаружении гиперфенилаланемии более 2,2 мг% ребенка направляют к детскому генетику для повторного обследования.
- Биохимические исследования. Для подтверждения диагноза фенилкетонурии проверяется концентрация фенилаланина и тирозина в крови, определяют активность печеночных ферментов (фенилаланингидроксилазы), выполняется биохимическое исследование мочи (определение кетоновых кислот), метаболитов катехоламинов в моче и др.
- Неврологическое обследование. Дополнительно проводится ЭЭГ и МРТ головного мозга, осмотр ребенка детским неврологом.
- Пренатальная диагностика. Генетический дефект при фенилкетонурии может быть обнаружен еще на этапе беременности в ходе инвазивной пренатальной диагностики плода (хорионбиопсии, амниоцентеза, кордоцентеза). В остальных случаях окончательный диагноз выставляется по результатам ДНК-диагностики после рождения.
Дифференциальный диагноз фенилкетонурии проводят с внутричерепной родовой травмой новорожденных, внутриутробными инфекциями, другими нарушениями обмена аминокислот.
Лечение фенилкетонурии
Основополагающим фактором в лечении фенилкетонурии является соблюдение диеты, ограничивающей поступление белка в организм. Лечение рекомендуется начинать при концентрации фенилаланина >6 мг%. Для грудных детей разработаны специальные смеси — Афенилак, Лофенилак; для детей старше 1 года – Тетрафен, Фенил-фри; старше 8 лет — Максамум-ХР и др. Основу диеты составляют низкобелковые продукты — фрукты, овощи, соки, белковые гидролизаты и аминокислотные смеси. Расширение диеты возможно после 18 лет в связи с возрастанием толерантности к фенилаланину. В соответствии с российским законодательством обеспечение лиц, страдающих фенилкетонурией, лечебным питанием, должна осуществляться бесплатно.
Больным назначается прием минеральных соединений, витаминов группы В и др.; по показаниям — ноотропные средства, антиконвульсанты. В комплексной терапии фенилкетонурии широко используется общий массаж, ЛФК, иглорефлексотерапия. Атипичные формы фенилкетонурии, не поддающиеся лечению диетой, требуют назначения гепатопротекторов, противосудорожных средств, заместительной терапии леводопой, 5-гидрокситриптофаном.
Дети, страдающие фенилкетонурией, находятся под наблюдением участкового педиатра и психоневролога; нередко нуждаются в помощи логопеда и дефектолога. Необходим тщательный мониторинг нервно-психического статуса детей, контроль уровня фенилаланина в крови и показателей электроэнцефалограммы.
Прогноз и профилактика
Проведения массового скрининга на фенилкетонурию в неонатальном периоде позволяет организовать раннюю диетотерапию и предотвратить тяжелые церебральные повреждения, нарушения функции печени. При раннем назначении элиминационной диеты при классической фенилкетонурии прогноз развития детей хороший. При поздно начатом лечении прогноз в отношении умственного развития неблагоприятный.
Профилактика осложнений фенилкетонурии заключается в проведении массового скрининга новорожденных, раннего назначения и длительного соблюдения диетического питания.
С целью оценки риска рождения ребенка с фенилкетонурией предварительное генетическое консультирование должны пройти супружеские пары, уже имеющие больного ребенка, состоящие в кровнородственном браке, имеющие родственников с данным заболеванием. Женщины с фенилкетонурией, планирующие беременность, должны соблюдать строгую диету до зачатия и во время беременности для исключения повышения уровня фенилаланина и его метаболитов и нарушения развития генетически здорового плода. Риск рождения ребенка с фенилкетонурией у родителей-носителей дефектного гена, составляет 1:4.
Фенилкетонурия — симптомы и лечение
Что такое фенилкетонурия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Алексенцевой Елены Сергеевны, педиатра со стажем в 14 лет.
Над статьей доктора Алексенцевой Елены Сергеевны работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Педиатр Cтаж — 14 лет
Перинатальный центр
«Центр Современной Педиатрии» на Московском проспекте 130
«Центр Современной Педиатрии» на Московском проспекте 120
Дата публикации 16 марта 2020 Обновлено 29 ноября 2021
Определение болезни. Причины заболевания
Фенилкетонурия (ФКУ) — генетическое заболевание, в основе которого лежит врождённое нарушение метаболизма аминокислот, характеризующееся повышенным содержанием фенилаланина в крови. Это аутосомно-рецессивная патология, т. е. ребёнок может унаследовать данное заболевание только в том случае, если оба родителя являются носителями дефектной версии гена.
ФКУ связана с дефектом в гене PAH (Phenylalanine hydroxylase gene). Этот ген участвует в образовании фенилаланин-гидроксилазы — печёночного фермента, ответственного за расщепление фенилаланина. Из-за дефекта гена количество этого фермента снижается, а уровень фенилаланина в организме увеличивается, что влечёт за собой такие тяжёлые и необратимые последствия, как умственная отсталость глубокой степени и эпилептические приступы, плохо отвечающие на стандартную антиконвульсантную терапию. П ытаясь избавиться от избытка фенилаланина и его метаболитов ( фенилпировиноградной и фенилуксусной кислот), организм выводит их с мочой .
Распространённость фенилкетонурии
Распространённость фенилкетонурии широко варьируется во всём мире. В Европе частота встречаемости данного заболевания составляет 1 случай на 10 000 живорождённых детей, но для некоторых районов она значительно выше, что связано с большим количеством близкородственных браков. Например, в Турции фенилкетонурия выявляется примерно у одного из 4000 живорождённых детей [1] . В Финляндии, по данным статистики, зарегистрирована самая низкая частота ФКУ среди Европейских стран: 1 случай на 100 000 детей [2] . Что касается нашей страны, усреднённый показатель распространённости данного заболевания — 1 случай на 7000 живорождённых детей.
Факторы риска фенилкетонурии
Основной фактор риска фенилкетонурии — это наличие у обоих родителей дефекта в гене PAH (Phenylalanine hydroxylase gene). Заболевание развивается, если оба родителя передают ребёнку копию повреждённого гена.
Другим ф актором развития фенилкетонурии можно назвать этническую принадлежность ребёнка. Считается, что у афроамериканцев данное заболевание встречается реже, чем у других этнических групп [22] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы фенилкетонурии
Как проявляется фенилкетонурия у новорождённых
У новорождённых с фенилкетонурией симптомы изначально отсутствуют и развиваются медленно, в течение нескольких месяцев, что связанно с постепенным накоплением в организме фенилаланина [3] . Выявить заболевание можно только с помощью неонатального скрининга.
Чем дольше ребёнок с фенилкетонурией не получает специфического лечения, тем быстрее развивается умственная отсталость и необратимые нарушения развития. Кроме того, для детей с фенилкетонурией характерны следующие признаки [4] :
- специфический неприятный запах изо рта, от кожи или мочи, который можно сравнить с затхлым «мышиным» запахом;
- приступы тошноты и рвоты;
- светочувствительность;
- неврологические нарушения, которые нередко могут включать эпилепсию (50 %);
- экстрапирамидные нарушения (паркинсонизм — неврологический синдром, который характеризуется тремором в состоянии покоя, мышечной ригидностью и общей замедленностью движений);
- нарушения зрения: косоглазие, атрофия зрительного нерва, снижение остроты зрения;
- кожные высыпания по типу экземы, локализующиеся на любых участках тела;
- светлая кожа и голубые глаза (из-за невозможности фенилаланина превращаться в меланин);
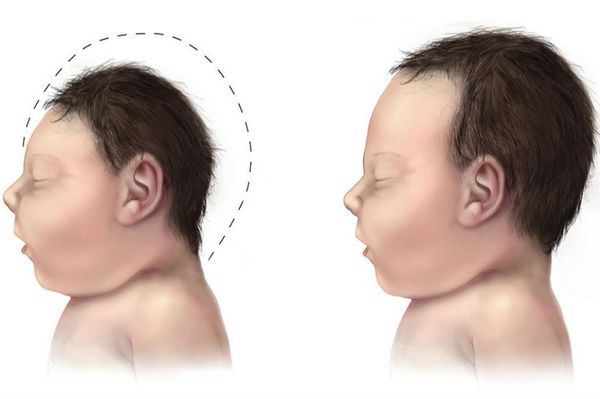
- микроцефалия (уменьшение размеров черепа и головного мозга при нормальных размерах других частей тела);
- гиперактивность: беспокойство, неконтролируемые вспышки гнева, невозможность сосредоточиться на выполняемых задачах, спонтанное снижение концентрации;
- интеллектуальная недееспособность: от лёгкой недостаточности интеллекта до идиотии и имбецильности;
- проблемы в поведенческой, эмоциональной и социальной сферах: трудности обучения в образовательных учреждениях, снижение мотивации при выполнении рабочих задач, снижение социальных коммуникаций, раздражительность, перепады настроения, социальная изоляция;
- психические расстройства: депрессии, генерализованные тревоги, шизофрения, биполярное расстройство.
У детей, рождённых от матерей с фенилкетонурией и неконтролируемым уровнем фенилаланина в крови, риск умственной отсталости значительно выше , поскольку они подвергаются воздействию очень высоких и токсичных уровней фенилаланина ещё до рождения. Такие дети могут иметь низкий вес при рождении, что вызывает проблемы прибавки массы и физического развития в будущем. Кроме того, умственно они развиваются значительно медленнее, чем их здоровые сверстники. Другими характерными признаками являются различные пороки сердечно-сосудистой системы (тетрада Фалло, коарктация аорты, дефект межжелудочковой перегородки, дефект межпредсердной перегородки) и поведенческие проблемы, связанные в будущем с нарушением социальной адаптации [5] .
Патогенез фенилкетонурии
Фенилкетонурия как самостоятельное заболевание было открыто норвежским врачом Иваром Асбьёрном Фёллингом ещё в 1934 году. Несмотря на это, вопрос о патогенезе долгое время оставался открытым.
Фенилаланин — это незаменимая аминокислота, которая участвует с синтезе белков. Незаменимая она потому, что организм не может самостоятельно её синтезировать, фенилаланин можно получить исключительно из пищи (мясных и рыбных продуктов, творога, сыра, яйц, орехов, хлебобулочных изделий, круп) или с помощью протеолиза — процесса гидролиза белков с помощью ферментов-протеаз.
Основной метаболический путь фенилаланина включает его преобразование до тирозина под действием фермента фенилаланин-гидроксилазы, который обнаруживается в печени и почках. Тирозин — это аминокислота, которая участвует в образовании таких важных соединений, как нейромедиаторы (дофамин, адреналин и норадреналин) и пигмент меланин. Нейромедиаторы передают электрические импульсы между нервными клетками (нейронами) и от нейронов к другим клеткам (например мышечным или железистым), что имеет немаловажную роль в когнитивной деятельности. Пигмент меланин защищает организм человека от воздействия ультрафиолетовых лучей [6] .
У пациентов, страдающих фенилкетонурией, из-за дефекта гена и недостатка фермента фенилаланин-гидроксилазы происходит увеличение в плазме крови концентрации фенилаланина (более 1200 мкмоль/л при норме 0-120 мкмоль/л ) и его метаболитов. Одновременно с этим снижается уровень тирозина и его производных (дофамина, адреналина, норадреналина и меланина). Такое состояние оказывает выраженное нейротоксическое действие на структуры мозга. Если пациент с фенилкетонурией не получает или не соблюдает лечение, то у него отмечаются повреждения мозолистого тела, полосатого тела, изменения коры и гипомиелинизация (снижение содержания миелина, образующего оболочку нервных волокон, в различных структурах оболочек мозга). Эти изменения могут привести к снижению интеллектуального развития и нейродегенерации — прогрессирующей гибели нервных клеток. Поэтому пациенты с фенилкетонурией более восприимчивы к нарушениям, связанным с дефицитом дофамина в головном мозге, таким как паркинсонизм.
Хотя патофизиологические механизмы повреждения головного мозга у пациентов с фенилкетонурией ещё не совсем понятны, существует множество свидетельств метаболических изменений, которые включают:
- дефицит биоэнергетики (нарушение процессов преобразования энергии в организме человека);
- окислительный стресс;
- нарушение метаболизма липидов и белков;
- нарушение оптимального уровня кальция и синтеза нейромедиаторов в головном мозге.
Окислительный стресс — это повреждение клеток активными формами кислорода, которые представляют собой молекулы с повышенной реактивностью из-за наличия неспаренного электрона на внешнем электронном уровне. Активные формы кислорода образуются в клетках постоянно, но в норме их уровень настолько низкий, что организм самостоятельно их нейтрализует с помощью антиоксидантной системы. Окислительный стресс происходит в том случае, когда активных форм кислорода образуется слишком много и антиоксиданты не могут полностью их инактивировать. Такой дисбаланс может вызвать окислительное повреждение белков, липидов или ДНК.
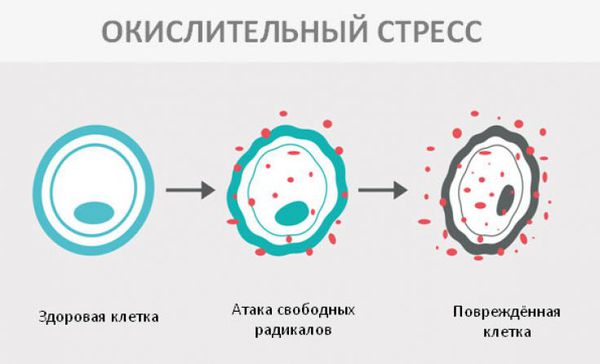
В ходе исследований окислительного повреждения макромолекул у пациентов с фенилкетонурией удалось установить, что увеличение концентрации фенилаланина в сыворотке крови (гиперфенилаланинемия) вызывает снижение антиоксидантоной защиты, что и приводит к окислительному стрессу [8] .
Ткани мозга особенно уязвимы для окислительного стресса из-за высокого потребления кислорода, высоких концентраций железа в тканях, низкого уровня антиоксидантной защиты, что способствует избыточному синтезу перекиси водорода (одной из форм активного кислорода) [7] .
Классификация и стадии развития фенилкетонурии
Согласно Европейской классификации, различают несколько вариантов течения данного заболевания [12] .
- Классическая фенилкетонурия характеризуется полным или практически полным дефицитом фенилаланин-гидроксилазы в печени. Сопровождается диетической переносимостью фенилаланина < 250-350 мг/день и концентрацией фенилаланина в крови при нормальной диете свыше 1200 мкмоль/л. При отсутствии своевременной диагностики первые клинические признаки заболевания отмечаются уже на первом году жизни ребёнка: родители жалуются на общую вялость, частые беспокойства, срыгивания при кормлении, проявления атопического дерматита. При осмотре ребёнка отмечается мышечная гипотония, задержка нервно-психического развития, в некоторых случаях — микроцефалия. Отличительной особенностью являются эпилептические приступы, плохо поддающиеся купированию стандартными схемами антиконвульсантной терапии.
- Умеренная фенилкетонурия характеризуется низкой остаточной ферментативной активностью (низкой способностью имеющихся ферментов участвовать в расщеплении фенилаланина и его превращении в тирозин), переносимостью фенилаланина от 350 до 400 мг/день и концентрацией фенилаланина в крови 600-1200 мкмоль/л. Данная форма отличается от классической фенилкетонурии более поздней манифестацией (чаще — первый-второй год жизни) и более медленным прогрессированием клинических признаков при отсутствии лечения.
- Лёгкая гиперфенилаланинемия. Уровень фенилаланина в плазме крови составляет менее 600 мкмоль/л при обычной диете. При данной форме у детей клинические признаки заболевания отсутствуют, либо незначительны. Несмотря на это, такие дети требуют особого контроля содержания фенилаланина в крови и непрерывной оценки нервно-психического развития.
Осложнения фенилкетонурии
Самым грозным осложнением фенилкетонурии является прогрессирующая умственная отсталость при отсутствии лечения. Однако данное заболевание ассоциируется также с рядом других патологий, влияющих на жизнь и здоровье пациента.
Доказано, что уровень депрессии среди взрослых с фенилкетонурией значительно выше и составляет около 18 % [10] . У них отмечается резкое снижение продуктивности, нарушения сна, выраженная утомляемость на фоне привычной деятельности, подавленное настроение, потеря интереса к жизни и привычным делам, нарушения аппетита, мысли о самоубийстве.
Также у взрослых пациентов с фенилкетонурией очень высока распространённость неврологических симптомов: тремор рук (присутствует у трети пациентов), генерализованная дистония (неритмичные медленные насильственные движения в различных частях тела, которые сопровождаются своеобразным изменением мышечного тонуса), задержка когнитивного и моторного развития (особенно при нарушениях диетотерапии), паркинсонизм [11] .
Пожизненная диетотерапия ассоциирована с нарушением роста, снижением минеральной плотностей костей и дефицитом питательных веществ, что требует постоянного контроля у профильных специалистов.
Диагностика фенилкетонурии
Первым эффективным тестом на определение у пациента гиперфенилаланинемии был бактериальный анализ ингибирования, разработанный американским микробиологом Робертом Гатри в 1963 году. Этот тест был основан на потребностях фенилаланина для роста культуры грамположительной бактерии Bacillus subtilis. Данный тест был очень удобен для массового скрининга, т. к. пятно засохшей крови можно было получить в кабинете врача, используя специальную фильтровальную бумагу, а затем отправить по почте в конверте в необходимую лабораторию [13] .
Развитие медицины привело к созданию тандемной масс-спектрометрии для быстрого определения концентраций аминокислот в небольших объёмах крови или плазмы. Данный метод даёт более низкую частоту ложноположительных результатов, измеряя уровни фенилаланина и тирозина в исследуемых образцах.
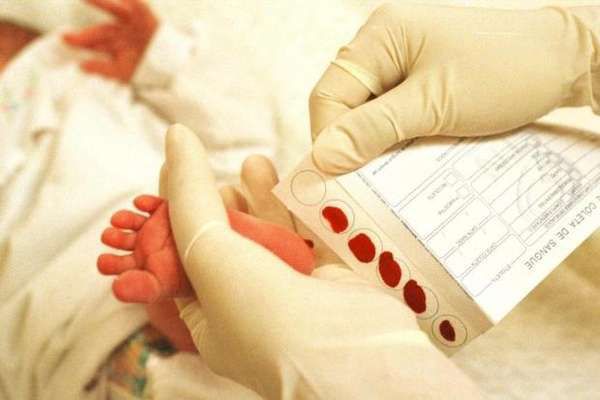
Основным методом ранней диагностики фенилкетонурии во всех странах мира принято считать неонатальный скрининг, который проводится в строго декретированные сроки для обеспечения своевременного начала лечения [12] . Неонатальный скрининг — это генетическое тестирование, которое позволяет выявить наиболее распространённые врождённые и наследственные заболевания у новорождённых детей.
В нашей стране проводится массовое обследование новорождённых детей на 5 наследственных заболеваний, одним из которых является ФКУ. Неонатальный скрининг проводится на четвёртые сутки жизни у доношенного ребёнка и на седьмые сутки у недоношенного ребёнка. В паспорте новорождённого и его истории болезни ставится пометка о проведении [14] .
Для неонатального скрининга медицинским персоналом с помощью скарификатора осуществляется забор крови из пятки новорождённого строго через 3 часа после кормления. Полученные образцы крови помещаются на специальные фильтровальные бумажные тест-бланки и отправляются в лабораторию.
Стоит отметить, что у некоторых детей, особенно у рождённых раньше срока, может наблюдаться незрелость ферментных систем, участвующих в метаболизме аминокислот. Это приводит к кратковременному повышению фенилаланина и положительному результату при скрининге [12] Около 2 % всех случаев повышенного уровня фенилаланина в крови, выявленного при скрининге новорождённых, связаны с нарушением метаболизма кофермента BH4, который участвует в преобразовании фенилаланина. Это подчёркивает важность проведения дифференциальной диагностики при всех выявленных уровнях гиперфенилаланинемии. Фенилкеторурию необходимо дифференцировать с такими заболеваниями, как транзиторная гиперфенилаланинемия недоношенных, наследственная доброкачественная гиперфенилаланинемия, тирозинемия, галактоземия.
Генотипирование не является необходимым методом для диагностики фенилкетонурии, но помогает специалистам определять степень дисфункции белка, остаточную активность фенилаланин-гидроксилазы , и, следовательно, метаболический фенотип, на основании которого в дальнейшем будет строиться тактика лечения.
Лечение фенилкетонурии
В 1990 г. исследователь Smith и его коллеги в своей работе доказали, что отсрочка старта лечения фенилкетонурии на каждые четыре недели приводит к падению показателя коэффициента интеллекта (IQ) примерно на 4 балла [15] .
Последнее Европейское руководство по фенилкетонурии акцентирует внимание на том, что лечение заболевания следует начинать до достижения возраста 10 дней, что для многих стран потребует изменения сроков проведения неонатальных скринингов и ассоциированных с ним процедур. В нашей стране сроки проведения неонатального скрининга соответствуют рекомендациям Европейского руководства по ФКУ (4 сутки жизни у доношенных новорождённых и 7 сутки жизни у недоношенных) [16] .
Тактика контроля фенилкетонурии определяется, в первую очередь, уровнем фенилаланина в крови пациента. Среди специалистов существует единодушное мнение, что уровень фенилаланина более 600 мкмоль/л является прямым показанием к незамедлительному лечению. Кроме нейропедиатра Росы Гассио Субиракс и её соавторов, никто не описывал крупных исследований по изучению необходимости лечения пациентов при уровне фенилаланина менее 360 мкмоль/л [17] . Таким пациентам рекомендовано с особой тщательностью проводить мониторинг данного показателя в течение первого года жизни, так как с возрастом есть риск повышения уровня фенилаланина.
Контроль уровня фенилаланина в крови
Мнение медицинского сообщества относительно начала лечения пациентов с концентрациями фенилаланина 360-600 мкмоль/л достаточно противоречивы. Costello и соавторы [18] проводили исследование, в котором пациенты были разделены на три группы:
- 1 группа — концентрация фенилаланина < 400 мкмоль/л;
- 2 группа — концентрация фенилаланина 400-500 мкмоль/л;
- 3 группа – концентрация фенилаланина > 500 мкмоль/л.
Исследователи обнаружили тенденцию к снижению IQ у лиц с более высоким уровнем фенилаланина и рекомендовали лечение, которое бы обеспечило поддержку уровня фенилаланина в крови < 400 мкмоль/л в течение всего периода детства.
Согласно Российским Федеральным клиническим рекомендациям, при концентрациях фенилаланина более 360 мкмоль/л пациенту назначается лечение.
Диета при фенилкетонурии
На сегодняшний день основным доказанным методом лечения фенилкетонурии считается диетотерапия, которая основывается на трёх подходах:
- Ограничение естественного белка с использованием индивидуальной толерантности к фенилаланину.
- Использование добавок L-аминокислот (не содержащих фенилаланин) для перекрытия физиологических потребностей в микроэлементах.
- Употребление пищи с низким содержанием белка для удовлетворения физиологических потребностей пациента в энергии [19] .
Общее потребление белка должно обеспечивать безопасные уровни потребностей данного макронутриента с дополнительной дотацией 40 % L-аминокислот (20 % L-аминокислот необходимы для компенсации потребностей в незаменимой аминокислоте и еще 20 % L-аминокислот используются для контроля фенилаланина в крови).
При введении неадекватных дозировок L-аминокислот они ограничивают синтез белка. Белковый обмен, который в норме складывается из процессов анаболизма (синтеза) и катаболизма (распада) белков, смещается в сторону катаболизма. При данном процессе фенилаланин остается неиспользованным для синтеза белка, и его концентрация в крови будет расти.
При фенилкетонурии необходимо избегать продуктов, богатых белком (мясо, рыба, яйца, обычный хлеб, большинство сыров, орехи и семена), а также продуктов, содержащих аспартам (подсластитель, который используется при изготовлении некоторых газированных изделий и конфет). Пища с низким содержанием белка при диетотерапии данного заболевания должна содержать 50 мг или менее фенилаланина на 100 г сухого продукта. Фрукты и овощи, содержащие менее 75 мг фенилаланина на 100 г пищевого продукта, также могут быть включены в рацион. При употреблении таких овощей, как картофель, брокколи, цветная капуста, брюссельская капуста, нужно учитывать, что даже их небольшое количество в рационе обеспечивает организм 50 мг фенилаланина, поэтому их потребление не должно быть бесконтрольным. Для удобства родителей и ребёнка следует пользоваться «пищевым светофором», где все продукты разделены на группы, разрешённые (ограниченно или неограниченно) и запрещённые к употреблению.
Когда ребёнок маленький, соблюдение диеты не является проблемой для семьи, так как родители контролируют потребление продуктов. В младенческом возрасте предлагается использовать специализированные смеси без добавок фенилаланина, которые дополняются либо грудным молоком, либо стандартной семью для перекрытия суточной потребности в фенилаланине.
Дети более старшего возраста продолжают не только пить специальный безфенилаланиновый продукт, который способен обеспечить потребности в белках и калориях, но и получают дополнительное количество разрешённых продуктов (овощи и фрукты, мёд, животные и растительные масла, зефир, пастила, варенье), необходимых для создания пищевого разнообразия.
По мере взросления ребёнка соблюдение диеты становится всё труднее, так как дети с фенилкетонурией, в отличие от своих сверстников, значительно ограничены в выборе продуктов, что часто приводит к скачкам концентрации фенилаланина у подростков [20] [21] Долгосрочное поддержание диеты необходимо, поскольку пациенты после периода нарушений диеты намного труднее возвращаются к прежнему режиму питания.
Прогноз. Профилактика
Хороший прогноз для интеллекта возможен в том случае, когда пациенты с первого месяца жизни получают диету с пониженным содержанием фенилаланина. Существует пропорциональная связь между гиперфенилаланинемией и IQ у пациентов с фенилкетонурией, где при повышении данной аминокислоты на каждые 100 мкмоль/л происходит снижение IQ на 1,3-4,1 пункта [15] .
Если пациенты с фенилкетонурией получают и соблюдают лечение с самого раннего возраста, то их качество и продолжительность жизни ничем не отличается от их здоровых сверстников.
Пациенты, не получающие или не соблюдающие лечение, часто имеют инвалидность и низкий уровень качества жизни. Кроме того, несоблюдение диеты и отсутствие контроля фенилаланина в организме часто приводит к снижению продуктивности и внимания, нарушению поведения (особенно при уровне аминокислоты свыше 360 мкмоль/л).
Адекватное наблюдение за концентрацией фенилаланина в пределах допустимых показателей достаточно эффективно в профилактике большинства нарушений центральной нервной системы. Большинство людей демонстрируют нормальное общее развитие, легко справляются с образовательными стандартами, ведут самостоятельную жизнь и получают работу, будучи взрослыми.
При соблюдении пациентом режимов диеты и дополнительной дотации минеральных веществ не отмечается увеличения риска таких осложнений, как остеопороз или частые переломы при отсутствии других заболеваний костно-мышечной системы и соединительной ткани.
Профилактика фенилкетонурии
Если у будущих родителей или их близких родственников выявлена фенилкетонурия, то при планировании беременности рекомендуется проконсультироваться с генетиком и пройти обследование. Так можно определить риск рождения ребёнка с фенилкетонурией.
Чтобы предотвратить врождённые нарушения у ребёнка, женщинам с фенилкетонурией во время беременности следует придерживаться диеты с низким содержанием фенилаланина [22] .
Список литературы
- Loeber J.G. Neonatal screening in Europe; the situation in 2004 // J Inherit Metab Dis. — 2007; 30: 430-438.ссылка
- Guldberg P., Henriksen K.F., Sipila I., Guttler F., de la Chapelle A. Phenylketonuria in a low incidence population: molecular characterisation of mutations in Finland // J Med Genet. — 1995; 32: 976-978.ссылка
- Williams R.A., Mamotte C.D., Burnett J.R. Phenylketonuria: an inborn error of phenylalanine metabolism // Clin Biochem Rev. — 2008; 29(1): 31-41.ссылка
- Sumaily K.M., Mujamammi A.H. Phenylketonuria: A new look at an old topic, advances in laboratory diagnosis, and therapeutic strategies // Int J Health Sci (Qassim). — 2017; 11(5): 63-70.ссылка
- Surtees R., Blau N. Neurochemistry of phenylketonuria // Eur J Pediatr. — 2000; 159: 109–113. ссылка
- Velema M.,Boot E.,Engelen M., Hollak C. Parkinsonism in phenylketonuria: a consequence of dopamine depletion? // JIMD Rep. — 20: 35-38ссылка
- Halliwell B., Gutteridge J.M.C. Free radicals in biology and medicine. — New York: Oxford University Press Inc, 2007.
- Sitta A., Manfredini V., Biasi L., Treméa R., Schwartz I.V., Wajner M., et al. Evidence that DNA damage is associated to phenylalanine blood levels in leukocytes from phenylketonuric patients // Mutat Res. — 2005; 679:13-6. ссылка
- Yuwiler A., Geller E., Slater G.G. On the mechanism of the brain serotonin depletion in experimental phenylketonuria // J Biol Chem. — 1965; 240: 1170-1174.
- Ford S., O’Driscoll M., MacDonald A. Living with Phenylketonuria: lessons from the PKU community // Mol Genet Metab Rep. — 2018; 17: 57-63.ссылка
- Hofman D.L., Champ C.L., Lawton C.L., Henderson M., Dye L. A systematic review of cognitive functioning in early treated adults with phenylketonuria // Orphanet J Rare Dis. — 2018; 13(1): 150. ссылка
- van Rijt W.J., et al. Inborn Errors of Metabolism That Cause Sudden Infant Death: A Systematic Review with Implications for Population Neonatal Screening Programmes // Neonatology. — 2016; 109: 297–302. ссылка
- Ramagopalan S.V., Rakyan V.K. The promise and challenges of blood spot methylomics // Epigenetics. — 2013; 8(8): 775–777.ссылка
- Фенилкетонурия и нарушения обмена тетрагидробиоптерина. Клинические рекомендации. — М., 2016; 45.
- Smith I., Beasley M.G., Ades A.E. Intelligence and quality of dietary treatment in phenylketonuria // Arch Dis Child. — 1990; 65(5): 472–478.ссылка
- van Wegberg A.M.J., MacDonald A., Ahring K., et al. The complete European guidelines on phenylketonuria: diagnosis and treatment // Orphanet J Rare Dis. — 2017; 12(1): 162. ссылка
- Gassio R., Artuch R., Vilaseca M.A., Fuste E., Boix C., Sans A., et al. Cognitive functions in classic phenylketonuria and mild hyperphenylalaninaemia: experience in a paediatric population // Dev Med Child Neurol. — 2005; 47(7): 443–448.ссылка
- Costello P.M., Beasley M.G., Tillotson S.L., Smith I. Intelligence in mild atypical phenylketonuria // Eur J Pediatr. — 1994; 153(4): 260–263.ссылка
- MacLeod E.L., Gleason S.T., van Calcar S.C., Ney D.M. Reassessment of phenylalanine tolerance in adults with phenylketonuria is needed as body mass changes // Mol Genet Metab. — 2009; 98: 331–337.ссылка
- Walter J.H., White F.J. Blood phenylalanine control in adolescents with phenylketonuria // Int J Adolesc Med Health. — 2004; 16: 41–45.ссылка
- Crone M.R., van Spronsen F.J., Oudshoorn K., Bekhof J., van Rijn G., Verkerk P.H. Behavioural factors related to metabolic control in patients with phenylketonuria // J Inherit Metab Dis — 2005; 28: 627-37.ссылка
- Mayo Clinic. Phenylketonuria (PKU). — 2018.
Источник https://www.krasotaimedicina.ru/diseases/children/phenylketonuria
Источник https://probolezny.ru/fenilketonuriya/
Источник